Redox is een type chemische reactie waarbij de oxidatietoestand van atomen verandert. Redoxreacties worden gekenmerkt door de feitelijke of formele overdracht van elektronen tussen chemische soorten, meestal waarbij één soort elektronen verliest terwijl een andere elektronen wint. De chemische soort waaruit het elektron is verwijderd, zou zijn geoxideerd. Terwijl de chemische soort waaraan het elektron is toegevoegd, zou zijn gereduceerd.
Met andere woorden:
Oxidatie is het verlies van elektronen of een toename van de oxidatietoestand van een atoom, een ion of van bepaalde atomen in een molecuul. Reductie is de toename van elektronen of een afname van de oxidatietoestand van een atoom, een ion of van bepaalde atomen in een molecuul.
Veel reacties in de organische chemie zijn redoxreacties als gevolg van veranderingen in oxidatietoestanden maar zonder duidelijke elektronenoverdracht.
Voorbeeld van een Redoxreactie
Tijdens de verbranding van hout met een moleculaire zuurstof, neemt de oxidatietoestand van koolstofatomen in het hout toe en die van zuurstofatomen neemt af naarmate kooldioxide en water worden gevormd. De zuurstofatomen ondergaan reductie, waarbij formeel elektronen worden gewonnen, terwijl de koolstofatomen oxidatie ondergaan en elektronen verliezen. Zuurstof is dus het oxidatiemiddel en koolstof is het reductiemiddel in deze reactie.
Redoxreacties kunnen relatief langzaam optreden, zoals bij roestvorming, of veel sneller, zoals bij verbranding van brandstof. Er zijn eenvoudige redoxprocessen, zoals de oxidatie van koolstof om kooldioxide te produceren of de reductie van koolstof door waterstof om methaan te verkrijgen.
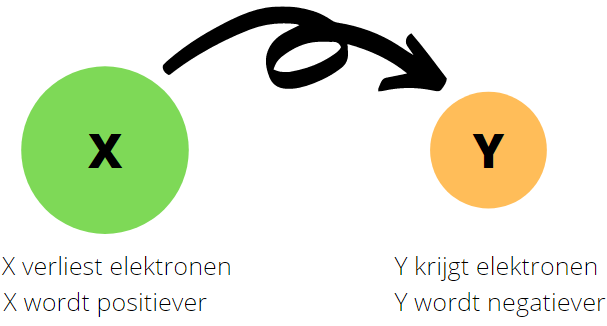
In de onderstaande afbeelding zie je het gevolg van een redoxreactie tussen atomen.